“艾”会消失吗?
人类免疫缺陷病毒(Human immunodeficiency virus,HIV)是导致艾滋病的罪魁祸首。截至2020年,全球约有3770万人感染了HIV[1],截至2020年10月底我国报告的现存艾滋病感染者104.5万例[2],艾滋病防治工作依然任重道远。
著名的“鸡尾酒疗法”也就是广泛使用的高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART),即通过联合使用三种或三种以上的药物(如抗病毒蛋白酶药物、抗病毒逆转录药物等)来减少血浆中的病毒,减轻HIV对免疫功能的破坏,减少机会性感染和癌症等并发症的发生。
截至2020年,73%的感染者使用ART控制HIV[3]。长期治疗能够有效延长患者生命,提升生存质量。然而HAART不能有效地消除潜在的病毒库,治疗副作用、药物高成本等问题也无法避免。因此通过消除潜在的病毒储存库来治疗HIV的新策略是迫切需要的。
CRISPR-Cas9清除HIV病毒储存库
CRISPR-Cas9基因编辑技术可对目标基因进行DNA修饰,在血液病、遗传病等治疗领域都展现了极大的应用前景。目前有研究团队尝试用CRISPR-Cas9基因编辑技术来清除HIV病毒储存库。
CRISPR-Cas9基因编辑体系主要包括“情报员”gRNA和“基因剪刀”Cas9蛋白。“情报员”gRNA找到目的DNA双链后,“基因剪刀”Cas9对其进行切割,使其断裂,随后机体启动HDR或NHEJ途径对其进行修复,修复可能导致序列插入、缺失或替换的发生,从而造成基因突变,达到清除病毒储存库的目的[4]。
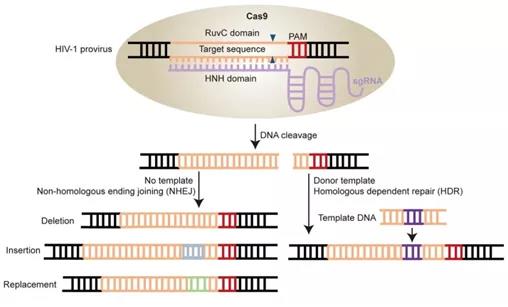
图1CRISPR-Cas9技术修饰HIV病毒库策略示意图[4]
一些实验室已经成功地利用这项技术导致细胞和小动物模型中HIV病毒基因表达和复制的永久性失活。同时使用多个“情报员”gRNA靶向病毒基因组的不同区域,可导致大部分HIV片段被去除,并降低病毒逃逸的风险[5]。
2021年9月,美国FDA接受Excision BioTherapeutics公司的CRISPR基因编辑治疗药物EBT-101的新药临床实验申请(Investigational New Drug Application,IND),允许该公司启动EBT-101的首次人体1/2期临床试验,这是HIV功能性治愈方法迈出的一大步[6]。
然而,通用sgRNA的构建、合适的CRISPR/Cas递送系统及脱靶效应仍是HIV功能性治愈方法发展需要面临的一些重大挑战[4]。随着技术的进步,我们期待CRISPR/Cas技术可以单独或与其他策略结合使用,在HIV-1/AIDS领域取得令人兴奋的进展。














